+400-6900-195
公司产品
特殊化学修饰siRNA
RNAi技术的最大难题就是化学合成siRNA稳定性问题。GenePharma化学修饰stableTMsiRNA最大的目标就是一次性获得最佳的实验数据。我们的方法就是使用RNAi-Mate转染试剂将化学修饰stableTMsiRNA导入哺乳动物细胞中,获得如下满意结果:
1、高效的基因沉默
2、高稳定性—在血清和培养基中
3、最大限度减少副作用
4、更长的作用时间
化学修饰stableTMsiRNA oligo与普通的siRNA oligo性能对照表
| 关键难题 | 标准的siRNA | 化学修饰stableTMsiRNA |
| siRNA 降解 | 标准的非修饰的siRNA在细胞培养过程中很容易降解,虽然在大部分的离体实验中是有效的,但是在细胞培养中寿命较短。 | GenePharma化学修饰stableTMsiRNA不仅增强了在血清和细胞培养中的寿命,而且加强了在离体条件下的应用能力。 |
| 作用时效 | 作用时间较短,一般情况下为1-3天。 | GenePharma化学修饰stableTMsiRNA作用时间长,比标准的siRNA的作用时间延长一倍左右。 |
| 活体应用的活性 | 标准的siRNA稳定性较差,一般不适用于体内试验。 | GenePharma化学修饰stableTMsiRNA在体内的稳定性强。 |
GenePharma 提供的siRNA 修饰方式
吉玛提供高纯度的siRNA。可提供选择的标记和修饰方式包括如下:
注:价格只是修饰费用,不包括RNA合成费用,oligo规格为OD数,价格单位为人民币:元.
| 5'端修饰 | 纯化方式 | 规格 | 价格 |
| Thiol | HPLC | 5 OD以内 | 300 |
| biotin | HPLC | 5 OD以内 | 300 |
| biotin-teg | HPLC | 5 OD以内 | 400 |
| chol | HPLC | 5 OD以内 | 300 |
| HEX | HPLC | 5 OD以内 | 300 |
| TET | HPLC | 5 OD以内 | 300 |
| FAM | HPLC | 5 OD以内 | 300 |
| CY3 | HPLC | 5 OD以内 | 300 |
| CY5 | HPLC | 5 OD以内 | 500 |
| C6-NH2-TFA | HPLC | 5 OD以内 | 300 |
| C6-NH2-MMT | HPLC | 5 OD以内 | 300 |
| C6-NH2-PDA | HPLC | 5 OD以内 | 300 |
| TAMRA | HPLC | 5 OD以内 | 300 |
| PHOS | HPLC | 5 OD以内 | 300 |
| Hexynl | HPLC | 5 OD以内 | 300 |
| CFR610 | HPLC | 5 OD以内 | 300 |
| 3'端修饰 | 纯化方式 | 规格 | 价格 |
| C7-NH2 | HPLC | 5 OD以内 | 200 |
| chol | HPLC | 5 OD以内 | 300 |
| BHQ-1 | HPLC | 5 OD以内 | 200 |
| BHQ-2 | HPLC | 5 OD以内 | 200 |
| DABCYL | HPLC | 5 OD以内 | 200 |
| FAM | HPLC | 5 OD以内 | 300 |
| CY3 | HPLC | 5 OD以内 | 300 |
| CY5 | HPLC | 5 OD以内 | 500 |
| Thiol | HPLC | 5 OD以内 | 300 |
| TAMRA | HPLC | 5 OD以内 | 300 |
| biotin | HPLC | 5 OD以内 | 300 |
| biotin-teg | HPLC | 5 OD以内 | 400 |
| ddC | HPLC | 5 OD以内 | 300 |
| GALNAC | HPLC | 5 OD以内 | 500 |
| PHOS | HPLC | 5 OD以内 | 300 |
| MGB | HPLC | 5 OD以内 | 400 |
| CFR610 | HPLC | 5 OD以内 | 300 |
| 中间体修饰(CEPA类) | 纯化方式 | 规格 | 价格 |
| spacer 18(PEG) | HPLC | 5 OD以内 | 200 |
| spacer 9 | HPLC | 5 OD以内 | 200 |
| SE(锁核酸) | HPLC | 5 OD以内 | 300 |
| 2'-ome | HPLC | 5 OD以内 | 100 |
| 2'-F | HPLC | 5 OD以内 | 100 |
| rI | HPLC | 5 OD以内 | 200 |
| dI | HPLC | 5 OD以内 | 200 |
| 5-Me-dC | HPLC | 5 OD以内 | 200 |
| 4’-Thiol-dU CEPA | HPLC | 5 OD以内 | 200 |
| idT-CEPA | HPLC | 5 OD以内 | 200 |
| 2'-MOE | HPLC | 5 OD以内 | 200 |
| Gemcitabine | HPLC | 5 OD以内 | 200 |
| Spacer C3 | HPLC | 5 OD以内 | 200 |
| 序列修饰 | 纯化方式 | 规格 | 价格 |
| ASO修饰 | HPLC | 5 OD以内 | 询价 |
| ESC修饰 | HPLC | 5 OD以内 | 询价 |
| PS修饰 | HPLC | 5 OD以内 | 询价 |
本公司提供的siRNA相关产品直接作用于靶基因mRNA,因此我们建议您在收到我们的相关产品后先进行实时定量PCR检测,以确定靶基因mRNA表达水平的变化,进而直接确认我们合成或构建的siRNA产品是否有效。
RNAi活体研究(In vivo RNAi)
在培养的哺乳动物细胞中,RNA干扰已经广泛应用于基因功能的研究。虽然RNAi干扰已经在体外(in vitro)研究中成为一个强大的研究方法,但是我们还是要着眼于将基因功能的研究放在整体生物中进行评价。为此,研究人员现在应用RNAi活体研究(RNAi in vivo)的方法来进行研究。虽然此项研究还处于早期,但是活体RNAi用已经越来越广使用并取得了不少进展。目前在活体研究中的两个基本方法:
1. 化学合成的siRNA
2. 质粒或者病毒载体的方法
化学合成方法容易合成,成本低,转染效率高,目前已经广泛应用于活体研究,质粒和病毒相对而言难于构建合成,并且经常有突变,转染效率低,有免疫原性等缺点。在活体水平,siRNA成功调控基因的成麽主要依赖于有效的传递方式,特异靶组织的siRNA富集浓度,siRNA的稳定性。目前已经有多报道应用局部注射或者全身性给药的方式,siRNA成功抑制基因表达。
吉玛化学修饰的stableTM siRNA已经成功应用于活体研究。
吉玛提供多种修饰方式的siRNA满足客户活体水平基因功能研究。我们的单体的修饰方式有2’-F, 2’-Ome,磷酸化修饰,胆固醇修饰,巯基修饰等。我们in vivo siRNA经过离子交换式的HPLC纯化,纯度>95%以上。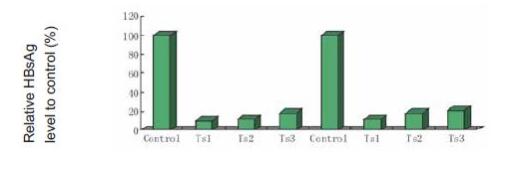
| 目录号 | 产品说明 | 规格 | 纯化方式 | 价格 | 交货期限 |
| A02004 | Chemically modified siRNA | 4 OD | HPLC | ¥600 | 6个工作日 |
| A02005 | Chemically modified siRNA | 5 OD | HPLC | ¥700 | 6个工作日 |
| A02010 | Chemically modified siRNA | 10OD | HPLC | ¥1300 | 6个工作日 |
| A02025 | Chemically modified siRNA | 25OD | HPLC | 询价 |
询问 |
| A02050 | Chemically modified siRNA | 50OD | HPLC | ¥5000 | 6个工作日 |
| A02100 | Chemically modified siRNA | 100OD | HPLC | ¥6500 | 8个工作日 |
| A02250 | Chemically modified siRNA | 250OD | HPLC |
询价 |
询问 |
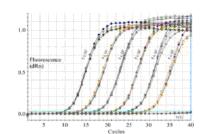
siRNA Real-Time PCR结果分析
对于RNAi实验而言,我们通常需要知道的是某一特定细胞在导入siRNA前后某一特定基因的表达变化情况来判断siRNA起到了Gene Knockdown作用。应用荧光定量PCR的方法,可以通过两种途径来实现上述判断,一是测定特定细胞在导入siRNA前后某一特定基因mRNA数量的变化,即为绝对定量;二是通过检测特定基因与某一管家基因在在导入siRNA前后相对表达情况的变化,即为相对定量。通常采用相对定量的方法来检测siRNA的Gene Knockdown作用。
1.Real-Time PCR 实验设计
Real-Time PCR实验设计时应包括实验组(导入siRNA),阴性对照(Negative Control)和Mock Transfaction三组。每组至少三个重复。各组同时检测目标基因和管家基因的Ct值。下例中以GAPDH为管家基因。

各组重复实验的Ct值差异不能过大;一般地,重复实验Ct值差异在1以内是可以接受的。
| 实验组 | 阴性对照(NC) | Mock Transfection | |||||||
| Target Gene | GAPDH | Target Gene | GAPDH | Target Gene | GAPDH | ||||
| 30.40 | 23.63 | 24.21 | 22.66 | 26.21 | 24.60 | ||||
| 30.35 | 23.40 | 24.60 | 22.56 | 26.15 | 24.31 | ||||
| 30.41 | 23.52 | 24.66 | 22.48 | 26.35 | 24.72 | ||||
以Mock Tansfection为对照(Calibrator),管家基因为Normalizer,ΔΔCt=(Ct目的基因-Ct管家基因)实验组-( Ct目的基因- Ct管家基因)对照
| Target Gene | GAPDH | ΔCt | ΔΔCt | Target Gene | |
| Average Ct | Average Ct | Target Gene–GAPDH | ΔCt–ΔCt, Mock | Rel. to Mock | |
| Mock | 26.24±0.10 | 24.54±0.21 | 1.7±0.21 | 0.00±0.21 | 1.0(1.16-0.86) |
| 实验组 | 30.39±0.09*1 | 23.51±0.15*2 | 6.88±0.17*3 | 5.18±0.17 | 0.027(0.0240.031) |
| NC | 24.49±0.24 | 22.56±0.09 | 1.93±0.25 | 0.23±0.25 | 0.85(0.71-1.01) |
|
注:*1 为同一样本重复实验的Ct值的标准偏差,可用Excel 计算得到; *2 计算公式为 ,例如 =0.17 *3 计算公式为2-△△Ct+S 和2-△△Ct-S,S为△△Ct的标准偏差,例如 2-(-2.5+0.10) =5.3 |
|||||

siRNA转染的方法
哺乳动物转染的常见方法有:磷酸钙共沉淀、电穿孔法、DEAE-葡聚糖和polybrene、机械法(例如,显微注射和基因枪)、阳离子脂质体试剂,其中阳离子脂质体试剂转染法是目前最常用的转染方法。
应用脂质体型转染试剂进行转染需要注重的几个方面:转染试剂的用量、siRNA的用量、转染时的细胞密度、转染时的操作顺序、细胞与转染试剂/siRNA复合物的温浴的时间。
A. GP-transfect-Mate 操作流程(24 孔板)
以24 孔板为例,若要检测基因沉默或者过表达效果,推荐最低RNA oligo终浓度为50nM
(DNA为0.5~1.5μg);遵循以下操作方法可以高效地将RNA oligo或者DNA转染贴壁和悬浮培养的多种真核细胞。但是对某些特殊的细胞系和培养条件,或特殊应用等,也需要单独特别优化,请参考表 1、表2。
1. 细胞铺板
转染时细胞密度:一般来说,当细胞密度达到60%~80%时进行转染可以取得较高的转染效率(参见表1)。然而,不同细胞的最适转染密度都不尽相同,因此在初次转染某种细胞时,可以通过预实验先确认该细胞最佳的转染密度。
2. 转染复合物的制备
(1)将 GP-transfect-Mate转染试剂放置于室温中,使用前轻轻混匀。
(2)在1.5 ml无菌离心管中加入50 μl无血清培养基或 OPTI-MEM,并添加适量的转染试剂(参见表2),用移液器轻轻混匀,室温静置5 min。
(3)同时在另一1.5 ml无菌离心管中加入50 μl无血清培养基或 OPTI-MEM,并添加适量的RNA oligo/DNA (参见表2),用移液器轻轻混匀,室温静置5 min。
(4)将GP-transfect-Mate-培养基混合物滴加至RNA oligo/DNA-培养基混合物中,用移液器轻轻混匀,室温静置15-20 min 后,立即转染。
注:复合物尽量在60 min内使用,并且GP-transfect-Mate-培养基混合物和RNA oligo/DNA-培养基混合物的混合次序非常重要,切勿颠倒。
3. 转染过程
(1)趁静置时,给 24 孔板换液,每孔换上 0.4ml 预热的新鲜培养基。
(2)将 100 µl 转染混合物加入孔中,终体系为500 µl。加完后将板轻轻晃动以使复合物均匀分布。
(3)37℃静置培养细胞,4-6h换成完全培养基。24-72 h检测mRNA表达,48-96 h检测蛋白表达。
适用范围
293T, A549, Beas-2B,HeLa,ECA-109,Raw264.7,A375,CAFs,HCT116,HT29,LMH,NE-4C,MGC803,PC-3, PC-12,MCF-7,C6等细胞。
表 1: 贴壁细胞或悬浮细胞接种数量、培养基体积
|
培养器皿 |
每孔表面积(cm2) |
每孔培养基的体积(ml) |
贴壁细胞转染前一天接种密度 |
悬浮细胞转染当天接种密度 |
|
|
96 孔板 |
0.3 |
0.1 |
5 000±2 500 |
2-5×104 |
|
|
24 孔板 |
2 |
0.5 |
25000±10 000 |
1-2.5×105 |
|
|
12 孔板 |
4 |
1 |
50000±20 000 |
2-5×105 |
|
|
6 孔板 |
10 |
2 |
150000±50 000 |
0.4-1×106 |
|
|
60mm |
20 |
4 |
400000±100 000 |
1-2.5×106 |
|
|
100mm |
60 |
10 |
1*106±250 000 |
2-5×106 |
|
注:贴壁细胞培养密度取决于培养器皿的表面积,而悬浮细胞则由培养基的体积决定。
表 2 不同培养板转染DNA/RNA oligo的推荐转染条件
|
培养器皿 |
Growth Medium |
Opti-MEM/ Serum-free Mediumfor complex |
DNA 转染 |
RNA转染 |
||
|
DNA/μg |
转染试剂/μl |
RNA/pmol |
转染试剂/μl |
|||
|
96 孔板 |
100 μl |
2×10μl |
0.2 |
0.4-1 |
20 |
0.5-1 |
|
24 孔板 |
500 μl |
2×50μl |
0.6 |
1.2-3 |
40 |
1-3 |
|
12 孔板 |
1ml |
2×100μl |
1.5 |
3-6 |
80 |
3-5 |
|
6 孔板 |
2 ml |
2×200 μl |
3 |
6-12.5 |
150 |
5-8 |
|
60mm |
5ml |
2×500 μl |
6-10 |
12-20 |
300 |
10-20 |
|
100mm |
10 ml |
2×1ml |
15-30 |
30-60 |
500 |
25-35 |
注:GP-transfect-Mate转染试剂的用量在此范围内进行优化。
B.Lipofectamin2000 转染试剂
选择最适合的转染试剂和转染条件,往往取决于不同的哺乳动物细胞类型和不同的核酸分子。Lipofectamin2000适用于核酸的体内和体外操作,可应用于DNA、RNA、反义寡核苷酸、siRNA的转染,也可应用于DNA/siRNA的共转染操作;是一种新型的高效siRNA转染试剂。
Lipofectamin2000的应用领域:
1、原代培养细胞和转化细胞株的基因转染
2、siRNA高通量转染试验
3、DNA转染;DNA和siRNA的共转染
4、核酸(siRNA、DNA、RNA)的体内导入试验
5、贴壁细胞和悬浮细胞转染
Lipofectamin2000 的特点:
1、不必更换培养基,操作简便易行,可在半小时内完成操作
2、在含血清培养基中也能表现高转染效率
3、细胞毒性低;适用细胞广泛
4、即用型试剂,可在含有抗生素的完全培养基中转染
5、基于脂质的转染试剂,确保没有RNAse活性
6、可介导siRNA高转染细胞及体内siRNA的高效导入
C. Lipofectamin2000适用的细胞类型
Lipofectamin2000转染试剂可广泛应用于多种细胞系的DNA和siRNA转染如:HeLa(人颈部癌细胞)、MCF-7(人乳房癌细胞)、Hep3B(人肝细胞癌细胞)、COS-7(猴肾细胞)、Neuro-2a(鼠神经母细胞瘤细胞)、NIKS(人角质化细胞)、B16(鼠黑素瘤细胞)、DLD-1(人结肠癌细胞)、NIH/3T3(鼠胚胎成纤维细胞)、HT-29(人结肠腺癌细胞)、A549(人肺癌细胞)、CHO-k1(仓鼠卵巢细胞)和293(腺病毒5 DNA转化的人胚胎肾细胞),SVRbag4细胞等。
D.转染前细胞培养
在细胞板上培养细胞时,应使细胞汇合在24小时内达到70-90%。
E.合适的lipofectamin2000用量
合适的siRNA(DNA):lipofetamin2000比例对核酸的高效转染有重要影响;我们推荐的DNA:lipofetamin2000为1:0.5—1:5(ug:ul),siRNA:lipofectamin2000为1:0.01-1:0.1(pmol:ul)一般情况下,此范围内都可获得高的转染效率。
F.贴壁细胞转染程序
选用生理状态良好的细胞对提高转染效率很重要。siRNA(DNA)和lipofectamin的用量和两者的比例可在推荐范围内适当调整。
1、转染前一天,4-5´104细胞接种在24孔板上, 0.5mL含FBS和抗生素的DMEM(或Opti-MEM,其他培养基)细胞培养基。
2、选择用于初期接种的细胞数量,应能在24小时内使细胞汇合达到70-90%。
3、在50μl的DMEM(或Opti-MEM,或其他无血清培养基)无血清培养基加入20pmol siRNA(或0.8μg DNA),柔和混匀;
4、混匀lipofectamin试剂,用50μl无血清的DMEM或Opti-MEM,或其他无血清培养基)稀释1μl lipofectamin试剂(DNA转染时,则加入2μllipofectamin试剂),轻轻混匀,室温放置5分钟;
5、将稀释好的siRNA和lipofectamin试剂混合;轻柔混匀,室温放置20分钟,以便形成siRNA/lipofectamin(或DNA/lipofectamin)复合物。
6、将100μl siRNA/lipofectamin(或DNA/lipofectamin)复合物加到含有细胞和培养基的培养板的孔中,来回轻柔摇晃细胞培养板板。
7、 细胞在CO2培养箱中37℃温育24h-48h后,进行转染后的其它检测步骤。如果细胞株比较敏感,孵育4-6小时后,除去复合物,更换培养基。
G.悬浮细胞转染程序
1、转染的当天,收集细胞离心,用含FBS的培养基重悬。
2、在50μl的DMEM(或Opti-MEM,或其他无血清培养基)无血清的培养基加入20pmol siRNA(或0.8μg DNA),柔和混匀;
3、混匀lipofectamin试剂,用50μl无血清的DMEM或Opti-MEM,或其他无血清培养基)稀释1μl lipofectamin试剂(DNA转染时,则加入2μl lipofectamin试剂),轻轻混匀,室温放置5分钟;
4、将稀释好的siRNA和lipofectamin试剂混合;轻柔混匀,室温放置20分钟,以便形成siRNA/lipofectamin(或DNA/lipofectamin)复合物。
5、再加入400μL细胞悬浮液(细胞数量决定于细胞类型和转染后分析测试的时间)。
6、细胞在CO2培养箱中37℃温育24h-48h后,进行转染后的其它检测步骤。如果细胞株比较敏感,孵育4-6小时后,除去复合物,更换培养基。
H.DNA和siRNA共转染细胞
1、在转染的前一天,4-5´104细胞接种在24孔板上,0.5 mL含FBS和抗生素的细胞培养基。
2、选择用于初期接种的细胞密度,应能在24小时内使细胞汇合达到70-90%。
3、在100μL的无血清的培养基中稀释20pmol siRNA和0.2μg DNA,加入2μl lipofectamin试剂,充分混合,放置20分钟,以便形成siRNA/ DNA/lipofectamin复合物。
4、将siRNA/ DNA/lipofectamin复合物加入培养基中,轻轻混匀。
5、细胞在37℃温育24h-48h后,进行转染后的其它步骤。
I.siRNA体内导入方法
1、适量的siRNA或DNA溶于不含RNA酶的无菌水中,轻轻混匀,因为注射液体积有限,建议采用高浓度的siRNA或DNA,一般DNA为2μg /μL、siRNA为10μg /μL。
2、取适量的DNA、siRNA或siRNA\DNA复合物与lipofectamin混合。例如,在1#管中加入0.5μL的DNA(1μg)和0.5μL的siRNA(5μg),在2#管中加入0.55μL的lipofectamin(24μg)和0.45μL不含RNA酶的无菌水中,将1#管中的溶液加入2#管中,在室温下温育30分钟,以形成siRNA/DNA-lipofectamin复合物。
3、制备的siRNA/DNA-lipofectamine复合物可用于体内导入siRNA、DNA或siRNA\DNA。
1.Burgess JT, Bolderson E, Adams MN, Baird AM, Zhang SD, Gately KA, Umezawa K, O’Byrne KJ, Richard D. Activation and cleavage of SASH1 by caspase-3 mediates an apoptotic response. Cell death & disease. 2016 Nov; 7(11): e2469.
2.Cai H, Yao J, An Y, Chen X, Chen W, Wu D, Luo B, Yang Y, Jiang Y, Sun D, He X. LncRNA HOTAIR acts as competing endogenous RNA to control the expression of Notch3 via sponging miR-613 in pancreatic cancer. Oncotarget. 2017 May 16; 8(20): 32905-17. /span>. 2016 Nov; 7(11): e2469.
3.Chen M, Li J, Zhuang C, Cai Z. Increased lncRNA ABHD11-AS1 represses the malignant phenotypes of bladder cancer. Oncotarget. 2017 Apr 5; 8(17): 28176-86. cer. Oncotarget. 2017 May 16; 8(20): 32905-17. /span>. 2016 Nov; 7(11): e2469.
4.Ding X, Su Y, Wang C, Zhang F, Chen K, Wang Y, Li M, Wang W. Synergistic suppression of tumor angiogenesis by co-delivering of VEGF targeted siRNA and candesartan mediated by functionalized carbon nanovectors. ACS Applied Materials & Interfaces. 2017 Jun 15. Nov; 7(11): e2469.
5.Fan B, Kang L, Chen L, Sun P, Jin M, Wang Q, Bae YH, Huang W, Gao Z. Systemic siRNA delivery with a dual pH-responsive and tumor-targeted nanovector for inhibiting tumor growth and spontaneous metastasis in orthotopic murine model of breast carcinoma. Theranostics. 2017 Jan; 7(2): 357-76.
6.He M, Zhang W, Dong Y, Wang L, Fang T, Tang W, Lv B, Chen G, Yang B, Huang P, Xia J. Pro-inflammation NF-κB signaling triggers a positive feedback via enhancing cholesterol accumulation in liver cancer cells. Journal of Experimental & Clinical Cancer Research. 2017 Jan 18; 36(1): 15.
7.Mai S, Qu X, Li P, Ma Q, Cao C, Liu X. Global regulation of alternative RNA splicing by the SR-rich protein RBM39. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms. 2016 Aug; 1859(8): 1014-24. kmark: OLE_LINK163'>Journal of Experimental & Clinical Cancer Research. 2017 Jan 18; 36(1): 15.
8.Wang H, Shen Q, Zhang X, Yang C, Cui S, Sun Y, Wang L, Fan X, Xu S. The long non-coding RNA XIST controls non-small cell lung cancer proliferation and invasion by modulating miR-186-5p. Cellular Physiology and Biochemistry. 2017 Apr; 41(6): 2221-9. 63'>Journal of Experimental & Clinical Cancer Research. 2017 Jan 18; 36(1): 15.
9.Wang J, Chen H, Zhou Y, Su Q, Liu T, Li L. Levosimendan Pretreatment Inhibits Myocardial Apoptosis in Swine after Coronary Microembolization. Cellular Physiology and Biochemistry. 2017 May; 41(1): 67-78. esearch. 2017 Jan 18; 36(1): 15.
10.Yang C, Li YS, Wang QX, Huang K, Wei JW, Wang YF, Zhou JH, Yi KK, Zhang KL, Zhou BC, Liu C, Zeng L. EGFR/EGFRvIII remodels the cytoskeleton via epigenetic silencing of AJAP1 in glioma cells. Cancer Letters. 2017 Sep 10; 403: 119-27. 7 May; 41(1): 67-78. esearch. 2017 Jan 18; 36(1): 15.
11.Yu M, Han S, Kou Z, Dai J, Liu J, Wei C, Li Y, Jiang L, Sun Y. Lipid nanoparticle-based co-delivery of epirubicin and BCL-2 siRNA for enhanced intracellular drug release and reversing multidrug resistance. Artificial Cells, Nanomedicine, and Biotechnology. 2017 Apr 10.
12.Zhang J, Qin X, Wang B, Xu G, Qin Z, Wang J, Wu L, Ju X, Bose DD, Qiu F, Zhou H, Zou Z. Zinc oxide nanoparticles harness autophagy to induce cell death in lung epithelial cells. Cell Death and Disease. 2017 Jul; 8. yle='mso-bookmark:OLE_LINK68'>Artificial Cells, Nanomedicine, and Biotechnology. 2017 Apr 10.
13.Zhang Y, Zhang Q, Zhang M, Yuan M, Wang Z, Zhang J, Zhou X, Zhang Y, Lin F, Na H, Ren S, Zou Y. DC-SIGNR by influencing the lncRNA HNRNPKP2 upregulates the expression of CXCR4 in gastric cancer liver metastasis. Molecular cancer. 2017 Apr 13; 16(1): 78. Cells, Nanomedicine, and Biotechnology. 2017 Apr 10.
14.Zheng X, Pang X, Yang P, Wan X, Wei Y, Guo Q, Zhang Q, Jiang X. A hybrid siRNA delivery complex for enhanced brain penetration and precise amyloid plaque targeting in Alzheimer’s disease mice. Acta biomaterialia. 2017 Feb; 49: 388-401. dy> Cells, Nanomedicine, and Biotechnology. 2017 Apr 10.
15.Zhou Z, Li H, Wang K, Guo Q, L C, Jiang H, Hu Y, Qupicky D, Sun M. Bioreducible Cross-Linked Hyaluronic Acid/Calcium Phosphate Hybrid Nanoparticles for Specific Delivery of siRNA in Melanoma Tumor Therapy. ACS Applied Materials & Interfaces. 2017 Apr 10; 9: 14576-89. ne, and Biotechnology. 2017 Apr 10.
16.Li J, Wang F, Wang G, Sun Y, Cai J, Liu X, Zhang J, Lu X, Li Y, Chen M, Chen L, Jiang C. Combination epidermal growth factor receptor variant III peptide-pulsed dendritic cell vaccine with miR-326 results in enhanced killing on EGFRvIII-positive cells. Oncotarget. 2017 Apr 18; 8(16): 26256-68. /span>. 2017 Apr 10.
17.Kong X, Liu F, Gao J. MiR-155 promotes epithelial-mesenchymal transition in hepatocellular carcinoma cells through the activation of PI3K/SGK3/β-catenin signaling pathways. Oncotarget. 2016 Oct 4; 7(40): 66051-60. et. 2017 Apr 18; 8(16): 26256-68. /span>. 2017 Apr 10.
18.Zhang R, Guo H, Xu J, Li B, Liu YJ, Cheng C, Zhou C, Zhao Y, Liu Y. Activated platelets inhibit hepatocellular carcinoma cell differentiation and promote tumor progression via platelet-tumor cell binding. Oncotarget. 2016 Sep; 7(37): 60609-22.
19.Sun X, Han Q, Luo H, Pan X, Ji Y, Yang Y, Chen H, Wang F, Lai W, Guan X, Zhang Q, Tang Y, Chu J, Yu J, Shou W, Deng Y, Li X. Profiling analysis of long non-coding RNAs in early postnatal mouse hearts. Scientific Reports. 2017 Mat; 7: 43485.
20.Tan J, Yang L, Liu C, Yan Z. MicroRNA-26a targets MAPK6 to inhibit smooth muscle cell proliferation and vein graft neointimal hyperplasia. Scientific Reports. 2017 Apr; 7: 46602. a>Scientific Reports. 2017 Mat; 7: 43485.
目录分类 本商品目录中的产品介绍按以下内容分类:
1. RNA干扰研究工具
2. MicroRNA研究工具
产品价格 本产品目录中标示的价格均为国内统一零售参考价,全部为人民币价格。如果大量定购时,在标准价格的基础上有不同程度的优惠。
质量保证 凡吉玛公司的产品均有严格的质量保证。如果我们发现确实存在质量问题时,保证更换产品。如果在到货后一个月之内用户无提出异议,我们将视本产品为优良产品而不再受理投诉事宜。提出产品异议(或投诉)时,切莫在产品使用完(或快使用完)后提出,以备本公司回收产品,确认产品质量。由于订错产品而产生的退货情况,原则上由客户承担相关费用。发生投诉事宜时,公司只保证在产品价格额度范围之内酌情赔偿,恕不受理超过制品价格额度以上之部分。退款时需退还原始发票。
下单前请务必核对订购表客户信息和订购内容无误,订单一经确认,当天即启动生产。 超过当日17:00后不能修改或者取消,如果需要取消订单,由此产生的费用,将由客户承担。
【取消订单费用规则】
(1)当日17:00前,免费修改或取消。
(2)当日17:00到次日17:00前,按该项产品金额的50%收取。
(3)次日17:00后,按该项产品金额的100%收取。
| mimics |  |
更多产品订购